生物化学纯化揭示STE20磷酸化AMPK相关的蛋白
2023年01月31日
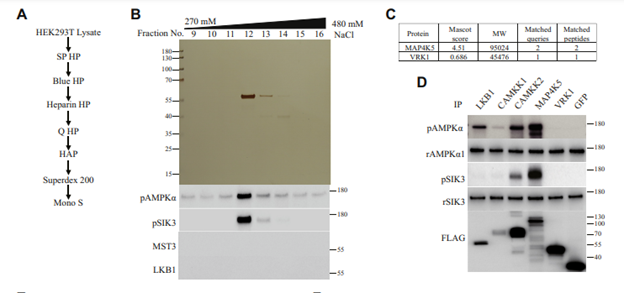
MST3和已知的SIK3和AMPK的上游激酶LKB1 KO之后,发现HEK293T和小鼠鼠脑中依旧存在不是LKB1和MST3的SIK3 T221和AMPKα1-T183磷酸化活性。再次将SP HP活性组分1-4依次经过Q HP、Blue HP、Heparin HP、 HAP、 Superdex200、MonoS蛋白色谱柱分离纯化纯化到相应的活性 CAMKK1/2,CAMKK1/2磷酸化SIK3 T221和AMPKα1-T183位点,这两个激酶以前被人发现确实可以磷酸化AMPK-T172,只是没有LKB1那么引人瞩目。除外CaMKK,在HEK里面还有活性可以磷酸化AMPK-T172和SIK3-T221,在第三次分离纯化发现MAP4K5可以磷酸化AMPK-T172和SIK3-T221。SIK3和AMPK属于AMPK家族,ARKs包括SIK1, SIK2, SIK3, AMPKα1, AMPKα2, BRSK1, BRSK2, MARK1, MARK2, MARK3, MARK4, NUAK1, NUAK2, MELK。通过细菌表达进行体外激酶反应,发现MST3和MAP4K5都能催化这14个AMPK家族激酶的磷酸化。其中有些有磷酸化抗体,有些用蛋白质质谱鉴定磷酸化。MST3和MAP4K5都属于哺乳类类似酵母STE20样的蛋白激酶亚家族。这个亚家族共有28个蛋白激酶。在HEK表达的28个STE20蛋白激酶,结果有些STE20可以催化SIK3-T221和AMPK-T172的磷酸化,有些STE20不可以。另外,细菌表达的28个STE20蛋白激酶有些能够磷酸化SIK3-T221和AMPK-T172,有些不能,这些结果大部分与HEK的类似,但不尽相同。通过少见的三轮生物化学分离纯化,发现重要的蛋白激酶AMPK及其类似激酶,可以被STE20家族的多个成员所磷酸化。尚不清楚这些体外生物化学发现的体内生理学意义。例如,不清楚STE20对AMPK的磷酸化是否调节代谢。也不清楚STE20的家族成员能否调节睡眠。如果STE20-AMPK上下游关系确实参与很多、很重要的生理学过程,这些发现就是重要的突破性发现。如果STE20-AMPK上下游关系在体内不参与重要生理学过程,这些发现就是体外的优美的生物化学,但类似水中的月,除了观赏,没有什么用处。